Beijing Duhengzhidao Pharmaceutical Technology Co., Ltd. является контрактной исследовательской организацией (Contract Research Organization) , специализирующейся на предоставлении профессиональных услуг в течение всего процесса клинических испытаний для исследования и разработки фармацевтических продуктов. Компания была основана в 2013 году и стремление снизить риски, связанные с исследованиями и разработками для клиентов, экономить средства на исследования и разработки, а также продвигать процесс вывода продукции на рынок. После многих лет напряженной работы и накопления опыта в отрасли мы помогли клиентам успешно получить одобренных продуктов. Основной бизнес включает в себя множество основных областей, таких как лекарства, медицинскые аппаратуры, здоровые питания и лечебно-оздоровительные продукты питания.
Штаб-квартира компании находится в Пекине, с филиалами в Южном Китае, Центральном Китае и Восточном Китае, а также офисами в Чжэнчжоу, Сиане, Ханчжоу, Гуанчжоу, Шицзячжуане, Северной Америке и других местах. Компания имеет профессиональную команду и предоставляет клиентам высококачественные услуги в различных областях на основе самых высоких профессиональных стандартов.
Речь генерального директора
Духэнчжидао — это CRO-компания, занимающаяся управлением рисками, связанными с инновационными медицинскими продуктами. Все сотрудники компании относятся к проектам с целью обеспечения качества обслуживания, ускорения выхода инновационных продуктов на рынок, снижения себестоимости клиентов, выполнения поставленных задач с высокой эффективностью и высокими стандартами.
Миссией компании всегда было укрепление здоровья всего человечества.
Цяо Чуньшэн
Основатель, генеральный директор
Станьте самой влиятельной CRO-компанией
Компания стремится предоставлять службы "одного окна" для крупной индустрии здравоохранения, включая лекарственные средства , медицинскые аппаратуры, продукты питания для специальных медицинских назначений и другие товары общего назначения для здоровья. Мы можем предоставить предварительные исследования и разработки, отечественные и зарубежные заявки на регистрацию и клинические испытания, а также постмаркетинговое выращивание большого разнообразия.
140+ клинических кооперативных больниц
6 офисов
170+ партнеров
Оценка клиента.
“Я хотел бы знать, как вы это делаете. Как стратегический партнер, ваша компания сохранила позитивный настрой на работу в прошлом сотрудничестве и выполнила рабочие проекты с высоким качеством. В предыдущем сотрудничестве ваш профессионализм был лучше, чем у любой другой компании CRO, с которой мы работали, поэтому мы надеемся работать с вашей компанией в течение длительного времени.” Лицо, ответственное за фармацевтическую компанию
Перманентные инновации
Глядя в будущее, мы стремимся управлять рисками, связанными с инновационными лекарствами, чтобы способствовать здоровому росту фармацевтической промышленности!
Качество на первом месте
Мы строго соблюдаем этику и правила клинических исследований и разработок, борьба за существование на основе качества ,с научным, строгим и правдивым профессиональным отношением, чтобы предоставлять пациентам безопасные и гарантированные продукты с помощью стандартизированных, высококачественных и эффективных услуг, связанных с клиническими исследованиями.
Поделитесь с вами инновационными идеями клинических исследований
Духэнчжидао будет регулярно делиться с вами отраслевыми идеями и новейшей информацией, чтобы вы могли узнать о нас и получить больше информации и ресурсов для ускорения клинических исследований.
Щелкните заголовок на блок-схеме, чтобы узнать больше.
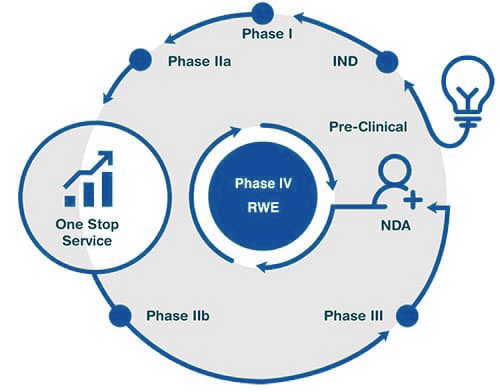
Мы используем надежные технологии и лучшие методы для обеспечения математической поддержки и решений для принятия вами решений в процессе разработки лекарств, помогая вам быстро продвигать свои продукты из лаборатории в клинику.
l Предварительные исследования и разработки.
l Отечественные и зарубежные регистрационные декларации на лекарственные средства, медицинскые аппаратуры, здоровые питания , специальное лечебное питание и т.д.
l Отечественные и зарубежные клинические исследования.
l Выведение крупных сортов после поступления на рынок.
l Проверка третьей стороной.
Клинические исследования, проводимые с новым лекарственным средством после того, как оно было рассмотрено и одобрено для продажи агентством по регулированию лекарственных средств, относятся к сфере постмаркетинговых исследований. По сравнению с клиническими испытаниями фазы II и I основная цель постмаркетинговых клинических исследований заключается в дальнейшем мониторинге безопасности и эффективности препарата в расширенной популяции.
Наша команда тесно сотрудничает с вами, чтобы разработать план проекта для ваших исследований, чтобы максимально повысить эффективность и снизить риск. Для клинических испытаний фазы 1, мы используем высокоуровневый дизайн испытаний, передовые биометрические технологии, отличных экспертов по ФК/ФД и богатый опыт управления проектами, предоставляем всесторонние решения, обеспечиваем быстрый и высококачественный сбор данных, анализ и отчеты, которые в конечном итоге принесут пользу вашей клинической практике.
Благодаря нашим обширным способностям в области биостатистики, мы можем разработать очень гибкий протокол исследования, поможет вам получить необходимые клинические данные без ненужных инвестиций на более позднем этапе. Кроме того, со специальными центрами вербовки и командами, мы также можем помочь вашему проекту быстро найти подходящего участника.
Наша команда тесно сотрудничает с вами, чтобы разработать план проекта для ваших исследований, чтобы максимально повысить эффективность и снизить риск. Для клинических испытаний фазы 1, мы используем высокоуровневый дизайн испытаний, передовые биометрические технологии, отличных экспертов по ФК/ФД и богатый опыт управления проектами, предоставляем всесторонние решения, обеспечиваем быстрый и высококачественный сбор данных, анализ и отчеты, которые в конечном итоге принесут пользу вашей клинической практике.
Благодаря нашим обширным способностям в области биостатистики, мы можем разработать очень гибкий протокол исследования, поможет вам получить необходимые клинические данные без ненужных инвестиций на более позднем этапе. Кроме того, со специальными центрами вербовки и командами, мы также можем помочь вашему проекту быстро найти подходящего участника.
Богатый опыт работы над проектами позволяет нам полностью понимать конкретные требования регулирующих органов по всему миру к заявочным материалам, точно понимать ключевые моменты регистрации продукта и поддерживать эффективную двустороннюю связь с клиентами и отделами по управлению лекарственными средствами на разных уровнях и в таких аспектах, как процедурных правил, нормативных требований и технического соответствия для обеспечения быстрого продвижения проекта.
Мы используем надежные технологии и лучшие методы для предоставления поддержки данных и решений для принятия решений в процессе разработки лекарств, помогая вам быстро продвигать свои продукты из лаборатории в клинику.
● Метаболизм и фармакокинетика лекарств (ДМПК)
● Службы токсикологии направляют новые методы лечения от открытия до всестороннего развития.
● Комплексные услуги биоанализа
● Фармацевтические исследования помогают ввести рецепт препарата в клинические исследования.
● Исследования биоэквивалентности помогают местным и международным клиентам регистрировать дженерики в NMPA Китая и FDA США.
Расширение масштабов клинических испытаний предъявляет более высокие требования к разработке исследования, набору участников входят в группу и опыту в смежных терапевтических областях. Мы разработаем решение, используя опытных клинических операторов, передовые ФК/ФД и биометрические технологии, чтобы удовлетворить ваши потребности в исследованиях и разработках.
Благодаря сильной системе управления качеством, совершенным стандартным операционным процедурам и богатому опыту управления международными проектами, мы успешно завершиоли множество крупномасштабных клинических исследований с высокой эффективностью и низкой стоимостью.
Расширение масштабов клинических испытаний предъявляет более высокие требования к разработке исследования, набору участников входят в группу и опыту в смежных терапевтических областях. Мы разработаем решение, используя опытных клинических операторов, передовые ФК/ФД и биометрические технологии, чтобы удовлетворить ваши потребности в исследованиях и разработках.
Благодаря сильной системе управления качеством, совершенным стандартным операционным процедурам и богатому опыту управления международными проектами, мы успешно завершиоли множество крупномасштабных клинических исследований с высокой эффективностью и низкой стоимостью.
Богатый опыт работы над проектами позволяет нам полностью понимать конкретные требования регулирующих органов по всему миру к заявочным материалам, точно понимать ключевые моменты регистрации продукта и поддерживать эффективную двустороннюю связь с клиентами и отделами по управлению лекарственными средствами на разных уровнях и в таких аспектах, как процедурных правил, нормативных требований и технического соответствия для обеспечения быстрого продвижения проекта.
выучить больше