北京度衡之道医药科技有限公司创立于2013年,是一家专注于为大健康产品研发提供全过程专业服务的合同研究组织(CRO)。致力为客户降低研发风险、节约研发经费,推进产品市场化进程。经过多年的努力及行业积累,主要业务涉及创新药,中药,特医食品、医疗器械和保健食品等多个核心领域。自成立以来,成功开展中药、化药、生物药、医用食品及医疗器械注册申报项目及临床试验项目280+。
公司立足中国走向世界,目前在东南亚和中亚等地为中国国内客户获批多个新药证书,在加拿大获批多款保健食品批文。
公司总部位于北京,在华南,华中,华东分别设有分公司,并在郑州、西安、杭州、武汉、南京、广州、石家庄、香港、澳门,温哥华等地设有办事处,在各个领域为客户提供服务。
为大健康产业提供一站式服务,包括药品、医疗器械、特医食品等大健康产品,提供前期研发、国内外注册申报、国内外临床试验以及上市后大品种培育等。
“作为战略合作伙伴,贵司在过去的合作中一直保持积极的工作态度,坚持以客户为中心,质量第一的理念,且能完整规范及时准确的完成工作项目。这也是我们希望与贵司长期合作的原因。”
某制药公司负责人
以客户为中心
质量第一
我们严格遵守临床研发的道德和法规,以质量求生存,以科学、严谨、求是的专业态度,通过规范、优质、高效的临床研究相关服务,为患者提供具有安全保障的产品。
度衡之道将与您定期分享行业洞见和最新资讯,让您了解我们的同时,也获取到更多加速临床研究的信息和资源。
了解更多点击流程图中的标题以了解更多信息
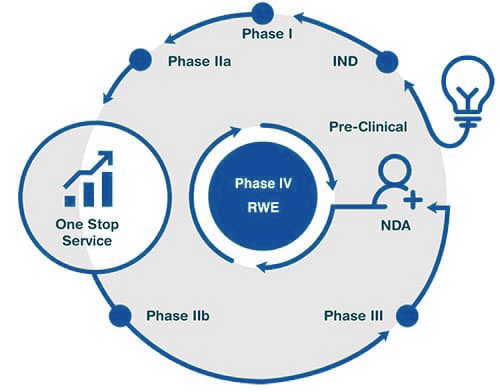
我们运用可靠的技术和最佳的方法,为您在药物研发过程中的决策提供数据支持和解决方案,助力您将产品从实验室快速推进到临床。
第三方稽查
新药在药品监管机构审核批准上市以后对其所进行的临床研究都属于上市后研究范围。与II、III期临床试验相比较,上市后临床研究的主要目的是对药品在扩大的人群中使用安全性及疗效的进一步监测。
了解更多
治疗作用初步评价阶段。其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量方案的确定提供依据。此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。
II期临床试验可以分为:IIa期和IIb期。
了解更多
根据法规要求准备临床前相关资料并递交IND申请。
丰富的项目经验确保能够充分理解全球各地监管部门对申报资料的具体要求,精准把握产品注册要点,从程序规定、法规要求、技术符合等多层次、多方面保持同客户、药政管理部门的双向有效沟通,保证项目的快速推进。
我们运用可靠的技术和最佳的方法,为您在药物研发过程中的决策提供数据支持和解决方案,助力您将产品从实验室快速推进到临床。
药学研究:原料药、制剂
非临床研究:药理学、药代动力学、毒理学研究
临床研究:
I~III期临床试验方案设计
知情同意书撰写
研究者手册撰写
风险管理计划
全方位提供IND申报的服务
IIb期(DF)也称为DF(Dose Finding,剂量发现)研究,目的是确定显示生物活性,而副作用最小的最佳剂量。在这个阶段评估药物的疗效以及安全性,为了找到III期试验中最佳剂量,主要疗效终点在给药后后期。
治疗作用确证阶段。其目的是进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。试验一般应为具有足够样本量的随机盲法对照试验。
根据临床前研究数据及临床数据总结并整理NDA申报资料。
丰富的项目经验确保能够充分理解全球各地监管部门对申报资料的具体要求,精准把握产品注册要点,从程序规定、法规要求、技术符合等多层次、多方面保持同客户、药政管理部门的双向有效沟通,保证项目的快速推进。