为进一步加强药品上市后变更管理,国家药品监督管理局组织制定了《药品上市后变更管理办法(试行)》以及相应的指导原则,药品注册按照中药、化学药、生物制品等进行分类管理,我司现就对各类药品变更事项法规及指导原则做一简单梳理。
《药品上市后变更管理办法》中指明药品上市后变更分为注册事项变更和生产监督事项变更。
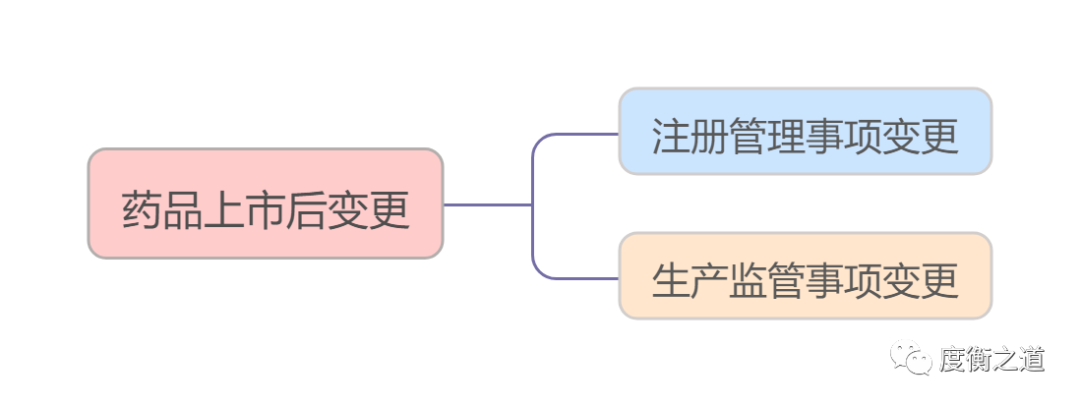
注册管理事项变更:
包括药品注册批准证明文件及其附件载明的技术内容和相应管理信息的变更,具体变更管理要求按照《药品注册管理办法》及相关技术指导原则的有关规定执行。
生产监管事项变更:
包括药品生产许可证载明的许可事项变更和登记事项变更,具体变更管理要求按照《药品注册管理办法》《药品生产监督管理办法》及药品生产质量管理规范的有关规定执行。
根据法律法规要求和变更对药品安全、有效和质量可控性可能产生影响的风险程度,分为审批类、备案类和报告类变更。
![]()
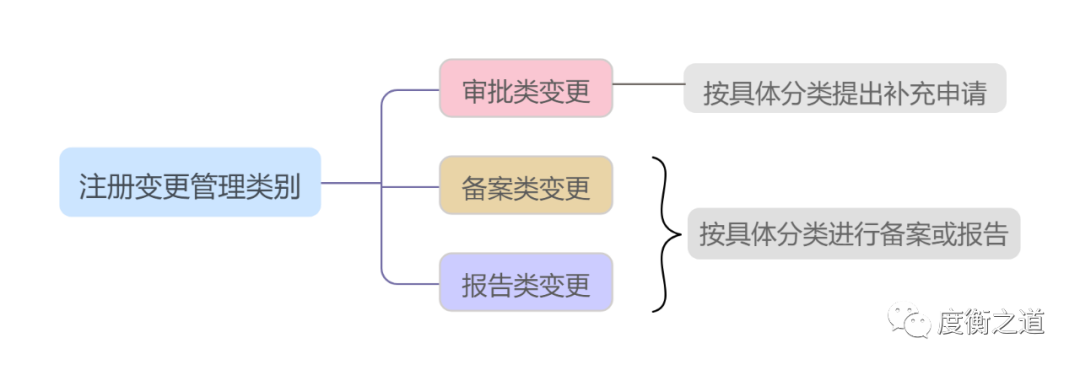
分别按照《药品注册管理办法》《药品生产监督管理办法》的有关规定经批准、备案后实施或报告。
化学药品、中药、生物制品变更事项的具体参考管理办法及指导原则如下:
药品上市后变更管理办法:
![]() 附件2.关于实施《药品上市后变更管理办法(试行)》的说明.doc
附件2.关于实施《药品上市后变更管理办法(试行)》的说明.doc
化学药品类变更:
![]() 附件6.已上市化学药品药学变更研究技术指导原则(试行).pdf
附件6.已上市化学药品药学变更研究技术指导原则(试行).pdf
![]() 附件7.《已上市化学药品和生物制品临床变更技术指导原则》.pdf
附件7.《已上市化学药品和生物制品临床变更技术指导原则》.pdf
中药类变更:
生物制品变更:
![]() 附件13.已上市生物制品药学变更研究技术指导原则(试行).pdf
附件13.已上市生物制品药学变更研究技术指导原则(试行).pdf
![]() 附件14.生物制品注册受理审查指南(第一部分 预防用生物制品)(试行).pdf
附件14.生物制品注册受理审查指南(第一部分 预防用生物制品)(试行).pdf
![]() 附件15.生物制品注册受理审查指南(第二部分 治疗用生物制品)(试行).pdf
附件15.生物制品注册受理审查指南(第二部分 治疗用生物制品)(试行).pdf
![]() 附件16.生物制品注册受理审查指南(第三部分 按生物制品管理的体外诊断试剂)(试行).pdf
附件16.生物制品注册受理审查指南(第三部分 按生物制品管理的体外诊断试剂)(试行).pdf


