【度衡课堂】IND和NDA申请完整流程图

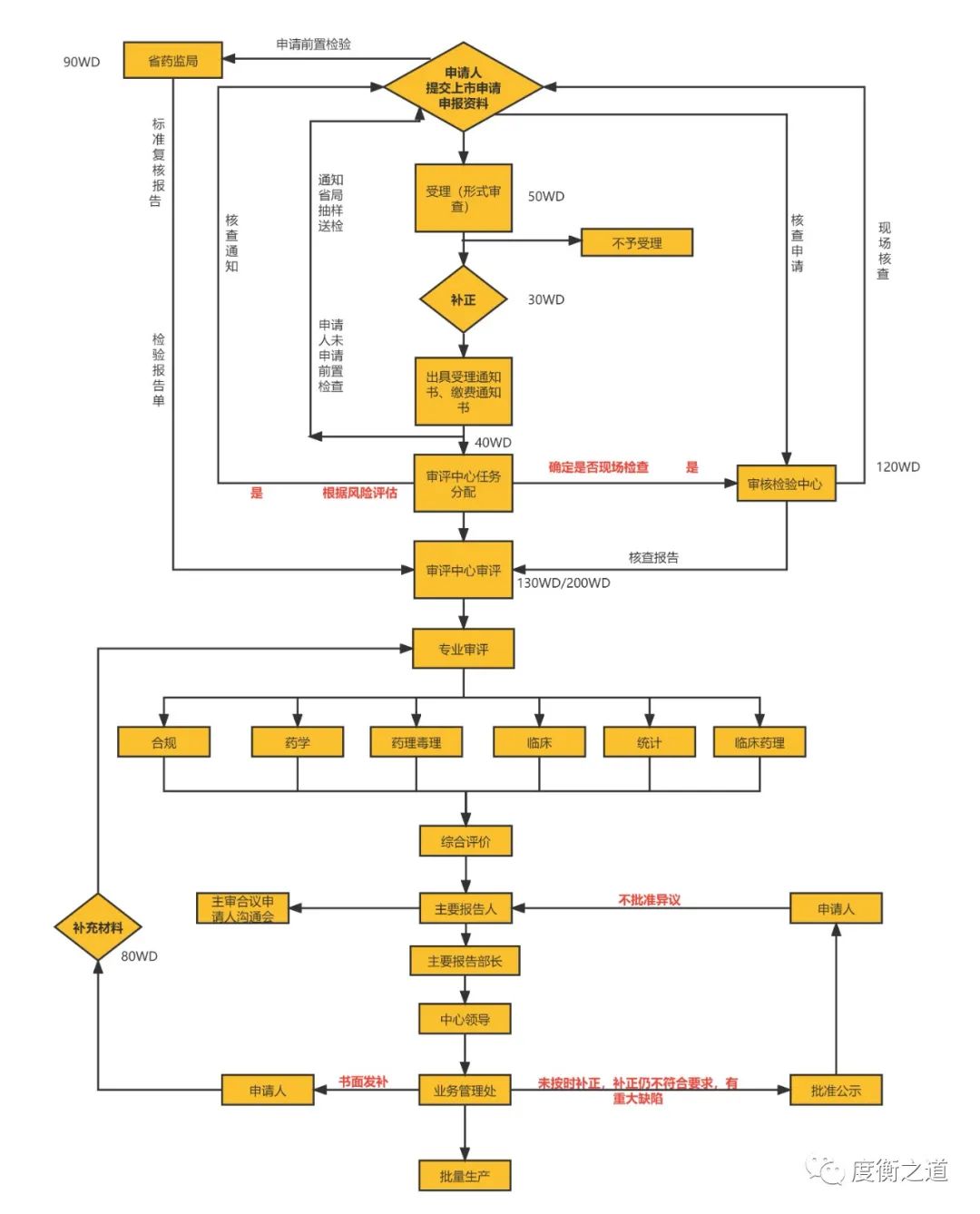
不妥之处请各位同仁批评指正,对感兴趣的注册内容可在评论区留言。如有关于注册方面的需求,可以联系我们。

长按识别二维码关注
电话:010-53345902
传真:010-65735819
地址:北京市朝阳北路龙湖长楹天街西区2栋2603-2606室

发布日期:2022-08-08
【度衡课堂】IND和NDA申请完整流程图


不妥之处请各位同仁批评指正,对感兴趣的注册内容可在评论区留言。如有关于注册方面的需求,可以联系我们。

长按识别二维码关注
电话:010-53345902
传真:010-65735819
地址:北京市朝阳北路龙湖长楹天街西区2栋2603-2606室